اهمية الحقن المجهرى فى علاج العقم
اهمية الحقن المجهرى فى علاج العقم
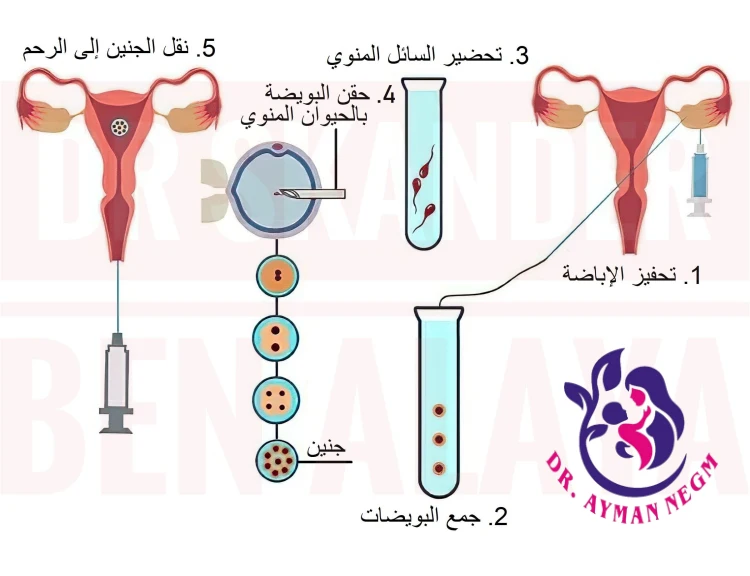
الحقن المجهري هو تقنية طبية متقدمة تُستخدم لعلاج العقم، خاصةً في الحالات التي تعاني من مشاكل في الحيوانات المنوية أو صعوبة في الإخصاب الطبيعي. تكمن أهمية الحقن المجهري في قدرته على زيادة فرص الحمل في الحالات التي قد تفشل فيها طرق الإخصاب الأخرى.
أهمية الحقن المجهري:
زيادة فرص الحمل:
يعمل الحقن المجهري على زيادة فرص تخصيب البويضات، خاصةً في الحالات التي تعاني فيها الحيوانات المنوية من مشاكل في الحركة أو العدد، أو عند وجود مشاكل في الإباضة لدى المرأة.
علاج مشاكل العقم:
يعتبر الحقن المجهري حلاً فعالاً للعديد من حالات العقم، بما في ذلك العقم غير المبرر، أو العقم المرتبط بمشاكل في الحيوانات المنوية أو البويضات.
إمكانية الفحص الوراثي:
يتيح الحقن المجهري إمكانية فحص الأجنة قبل زرعها في الرحم، مما يساعد في تحديد الأجنة السليمة وراثياً وتجنب انتقال الأمراض الوراثية.
تجميد الأجنة:
يمكن تجميد الأجنة الزائدة بعد عملية الحقن المجهري واستخدامها في محاولات لاحقة للحمل، مما يوفر الوقت والجهد.
حل لمشاكل العقم الشديدة:
في حالات العقم الشديدة، حيث يكون الإخصاب الطبيعي مستحيلاً، يعتبر الحقن المجهري أملًا للعديد من الأزواج لتحقيق حلم الإنجاب.
إن العقم مشكلة لكل واحد من كل عشرة من سكان الولايات المتحدة ، ويظهر اتجاها متزايدا على مدى العقود القليلة الماضية بسبب الفترة اللاحقة للحمل الأول. وفي العديد من هذه الحالات ، يستخدم بنجاح في الإخصاب الأنبوبي ، والتقنيات الأكثر تقدما مثل حقن الحيوانات المنوية داخل الأورام النباتية لبدء الحمل. في الوريد الأجوف السفلي ، يتم الجمع بين خلايا جرثومة الذكر والأنثى خارج الجسم ، ثم يتم إدخال المفاهيم الناتجة في وقت لاحق إلى الرحم. مع ICSI ، يتم حقن نواة الحيوانات المنوية مباشرة في خلية البيض.
ومع ذلك ، كل من هذه التقنيات تتطلب الحيوانات المنوية والبويضات أن تكون موجودة. عندما يتعلق الأمر بالأشخاص الذين يفتقرون إلى هذه الخلايا الجرثومية ، يجب البحث عن علاجات أخرى. نقص الحيوانات المنوية أو البيض يمكن أن يكون نتيجة الشذوذ الجيني ، العلاج الكيميائي أو الإشعاع ، أو في بعض الأحيان أسباب غير معروفة.
ويتمثل أحد الخيارات في استخدام بويضات المتبرع أو الحيوانات المنوية ، أو كليهما. ومع ذلك ، وكما يقول الباحث أماندر كلارك ، “مع البويضات والمني المتبرع بها ، لا يرتبط الطفل وراثيا لأحد الوالدين أو كليهما. ما نريد القيام به هو استخدام الخلايا الجذعية لتكون قادرة على توليد خلايا خارج الجسم البشري بحيث يمكن التغلب على هذا النوع من العقم.”
البداية
وتتطور جميع الأجنة من مجموعة من الخلايا غير المتمايزة الموجودة القادرة على النمو في العديد من الاتجاهات المختلفة لصنع أي نوع تقريبا من الخلايا في الجسم. هذه هي الخلايا الجذعية متعددة القوام ، الخلايا التي يمكن أن تؤدي أيضا إلى ظهور الحيوانات المنوية والبيض.
وقد اكتشف العلماء بالفعل كيفية جعل خلايا مشابهة جدا هذه من الفعل متباينة الكبار الجلد أو خلايا الدم بعكس التنموية الزمني المتحدة-التمييز بينها. وتسمى هذه الخلايا خلايا جذعية متعددة الطاقة المستحثة (iPSCs).
ألف-العملية
الدراسة الحالية استخدام التكنولوجيا لقياس الجينات التي كانت نشطة في أكثر من 100 ، 000 الجذعية الجنينية خلايا iPSCs كما أنها أدت إلى الحيوانات المنوية والبويضات. هذا الكم الهائل من المعلومات ثم تحليلها باستخدام وضعت حديثا خوارزميات من زملائهم في معهد ماساتشوستس للتكنولوجيا ، لتبين نمط التنمية.
وهكذا تمكن العلماء من التوصل إلى صورة عالية التحديد للعملية التي تتكون بها الخلايا الجرثومية. الخطوة الأولى وقعت في 24-48 ساعة ، عندما الخلايا الجذعية تبدأ في التمايز إلى أنواع مختلفة من الخلايا التي تستمر في تطوير في جميع المميزة و المتخصصة للغاية خلايا جسم الإنسان البالغ.
في اليوم ال12 بعد حقن مجهرى، في وقت قريب من زرع ولكن قبل أقرب تشكيل الجنينية أجزاء مثل بدائية متتالية أو gastrula ، فمن الممكن أن تعترف أقرب الخلايا الجذعية التي يتم التفريق في الخلية الجرثومية خط الإنتاج ، ودعا الإنسان البدائي الخلايا الجرثومية (hPGCs). عند هذه النقطة يتم تحديد الخلايا الشبيهة بhpgc (hPGCLCs) ، أو يتم فصلها عن طريق تغيير في التعبير الجيني نحو دولة انتقالية. وفي هذه المرحلة يتشاطرون خصائص الخلية الجذعية السابقة للزرع وكذلك الخلايا الجذعية الجنينية بعد الزرع ، التي توصف بالسذاجة والمعد ، على التوالي. ثم تتحول إلى المسار لتصبح خلايا جرثومية progenitors ، من خلال تنظيم منطقة الكروموسوم تحديد الجنس SOX17 التي هي مسؤولة عن مواصفات hPGCLC.
كم تستغرق عملية الحقن المجهري

تستغرق عملية الحقن المجهري، بما في ذلك جميع مراحلها، عادةً حوالي 4 إلى 6 أسابيع. تبدأ العملية بفحص المريضة والتحضير لها، ثم تحفيز المبايض لإنتاج البويضات، ثم سحب البويضات وتخصيبها في المختبر. وأخيرًا، يتم نقل الأجنة إلى الرحم بعد 3 إلى 5 أيام من التخصيب.
هل عملية الحقن المجهري مؤلمة
بشكل عام، عملية الحقن المجهري ليست مؤلمة، لكنها قد تتسبب في بعض الانزعاج خلال بعض المراحل. يتم إجراء عملية سحب البويضات عادةً تحت تأثير التخدير لتجنب الشعور بالألم، بينما تكون عملية نقل الأجنة إلى الرحم غير مؤلمة نسبيًا.
متى تظهر علامات فشل الحقن المجهري

عادةً ما تبدأ علامات فشل الحقن المجهري بالظهور خلال 10-14 يومًا من عملية نقل الأجنة، وتحديدًا قبل موعد تحليل الحمل. أهم هذه العلامات هو نزول الدورة الشهرية في موعدها المعتاد، بالإضافة إلى عدم ظهور أعراض الحمل أو الشعور بألم وتقلصات في منطقة الحوض.
قصص ذات صلة
استهداف الأنزيم الحرج لتكوين الحيوانات المنوية يمكن أن يساعد على معالجة عقم الذكور
الباحثون يكشفون الأحداث الجزيئية الكامنة وراء الاضطرابات الأيضية الناتجة عن النظام الغذائي الأبوي لدى الأطفال
الحمية تؤثر على الحيوانات المنوية وصحة النسل
في هذه النقطة ، hPGCLCs لم تعد تفرق في الخلايا الجسدية – وهذا ما يسمى معبر ايزمان الحاجز, بعد الأسطوري الأحياء الألماني الذي اقترح وجود عامل وراثي في الخلايا الجرثومية ، اليوم المعروف أن الحمض النووي. هذه هي النقطة الرئيسية في تحقيق إنتاج الأنابيب من المناجل ، أو الخلايا الجنسية (البيض والحيوانات المنوية).
ألف-الآثار
في التجربة الحالية ، يتم تحويل hPGCLCs primed مرة أخرى لتصبح خلايا جرثومية انتقال pluripotent وبالتالي تبدأ في التفريق إلى خلايا جرثومية. ويعرف الباحثون الآن متى يتدخلون حتى يتمكنوا من زيادة عدد الخلايا الجرثومية التي تتكون عن طريق تحويل المزيد من عملية التمايز إلى هذا التيار.
استنتاج آخر مثير للاهتمام هو أن الخلايا الجرثومية تنشأ من الخلايا الجذعية التي يكون منشؤها في السلى ، شفافة رقيقة الغشاء تحتوي على السوائل المحيطة بالجنين ، وكذلك gastrula تشكيل الخلايا التي تنتمي إلى الطفل السليم.
وأخيرا ، وجدوا أن أنماط تنشيط الجينات التي تؤدي إلى تشكيل الخلايا الجرثومية هي نفسها تقريبا ، سواء كانت خلية جذعية جنينية أو iPSC. وهذا يثبت أنهم يستخدمون التقنية الصحيحة لتشكيل الخلايا الجرثومية.
يقول كلارك: “الآن نحن مستعدون لاتخاذ الخطوة التالية من الجمع بين هذه الخلايا مع خلايا المبيض أو الخصية.”هذه الخلايا الجرثومية هي لم تقرر بعد بشأن ما إذا كان وضع في الحيوانات المنوية أو البويضات ، وهذا يعتمد على الإشارات الجزيئية التي يتلقونها سواء من المبيض أو الخصية.
ويقول الباحثون ، ” من خلال هذا العمل ، اكتشفنا مسار سلالة الإنسان واكتشفنا هوية المتقدمين المحتملين لزرع peri لhpgcs.”
ويأمل الباحثون أن يتمكنوا في نهاية المطاف من اقناع iPSCs تكونت من خلايا الجلد الخاصة بالمريض للتمييز إلى خلايا جرثومية وإلى أنسجة المبيض أو الخصية. ويمكن استخدام هذا للسماح لكل شخص بأن يحصل على خلايا جرثومه التي تم إنشاؤها في المختبر. غير أن هذه العملية طويلة الأمد وستتطلب بحثا وعملا مكثفين.
خطوة بعيدة جدا ؟
وقد اقتصرت هذه التقنيات على استخدام المختبرات ، ولم توافق عليها إدارة الأغذية والأدوية في الولايات المتحدة لاستخدامها في البشر ، كما أنها لم تخضع لاختبار بشري.
ومن الواضح أن مثل هذه التجارب تنطوي على الاستخدام الوفير للأجنة البشرية قبل الزرع. وعلى الرغم من استيفاء معايير الموافقة الأخلاقية ، فإن هذا الاختبار يثير مع ذلك العديد من المسائل الأخلاقية الأخرى. مرة أخرى, الدافع الحقيقي من البحث لا يزال في شك لأن عدم وجود قيمة الحياة البشرية المحتملة أظهرت هذه التجارب يجعل من الصعب أن نصدق أن يجعل من الممكن بالنسبة الأزواج الذين يعانون من العقم عن إنجاب الأطفال هو الحافز الحقيقي.
وأخيرا ، فإن احتمال سوء تطبيق هذه التكنولوجيا هو واضح ، مثال واحد فقط يتم استخدامه تسمح لكل من الحيوانات المنوية والبويضات التي سيتم إنشاؤها من نفس المريض ، رعايتها من قبل كل من المبيض و الخصية الأنسجة المستمدة من أن المريض في نهاية المطاف مما أدى إلى والد وحيد الزيجوت. ويأمل المرء ألا يسمح العلماء بتفشي فضولهم بل أن يكبحوا ذلك في حدود مناسبة بدلا من أن يدمروا حياة البشر بتقنية غير ضرورية-ببساطة لأنهم يستطيعون ذلك.
دكتور أيمن نجم
هدفنا هو مساعدتك على استعادة صحتك، تعزيز ثقتك بنفسك، وتمكينك من عيش حياة أكثر نشاطًا وحيوية

اتصل بنا
- الهاتف : 01128517117
- البريد : info@ivfeg.com
- العنوان :34 شارع الحجاز ميدان المحكمة
- جميع الحقوق محفوظة دكتور أيمن نجم 2026
- خبرة اكثر من ٢٠ عام في الحقن المجهري وعلاج العقم








اترك تعليقاً
يجب أنت تكون مسجل الدخول لتضيف تعليقاً.